Wissenschaftlicher Hintergrund zu Axomera
Elektrische Felder in der Natur und im menschlichen Organismus
Elektrische Potentiale sind in der Natur überall zu finden und beeinflussen als physikalische Kraft unterschiedliche Naturphänomene – von der Entladung der Atmosphäre, über Polarlichter, die Formation von Wolken, Wasserfällen bis hin zur Form von Schneeflocken. Biologische Organismen können elektrische Potentiale erzeugen, wie zum Beispiel der Zitteraal (Electrophorus electricus) oder sie dienen ihnen als elektromagnetische Felder der Orientierung von, wie zum Beispiel bei Zugvögeln und Fledermäusen.
In der Elektrophysiologie des Menschen ist seit langem bekannt, dass elektrische Ströme z.B. die Herzaktivität steuern, sie ermöglichen ferner die Signalverarbeitung der Sinnesorgane wie zum Beispiel in den Haarzellen des Ohres oder den photosensitiven Zellen des Auges, und sie sind grundlegend für die Funktion des Gehirns und die Nervenaktionspotentiale. Diese seit langem bekannte Elektrophysiologie ist Grundlage aller bekannten elektromedizinischen Stimulationsverfahren, von der transkutanen elektrischen Nervenstimulation (TENS) bis zum Herzschrittmacher, Defibrillator oder auch den neusten Verfahren zur Therapie von Parkinson oder Depressionen (Deep-Brain-Stimulation – DBS)
Bisher bekannte medizinische Stimulationsverfahren in der Schmerztherapie
Bisherige elektromedizinische Stimulationsverfahren zur Schmerztherapie adressieren nahezu alle die Aktivität der Aktionspotenziale peripherer Nozizeptoren (Schmerzrezeptoren). Mit möglichst hohen Strömen und/oder Frequenzen soll die Schmerzwahrnehmung verändert werden.
Zu diesen Verfahren gehört die transkutane elektrische Nervenstimulation (TENS), die perkutane Stimulation (z.B. Elektroakupunktur) oder die chirurgische Implantation von Geräten, wie sie als periphere Nervenstimulatoren (PNS), Rückenmarkstimulatoren (SCS) oder dorsale Wurzelganglion (DRG) Stimulatoren eingesetzt werden. Alle diese elektrischen Stimulationsgeräte arbeiten ähnlich und bedienen sich des gleichen elektrophysiologischen Prinzips. Dynamische, gepulste bipolare elektrische Reize (1-70 V, 1-90 mA, 1-1200 Hz, Impulsbreite von 0,2-250 ms) werden eingesetzt, um die Nervenzellen so zu „übersteuern“, dass sie keine weiteren Aktionspotenziale mehr generieren und damit die Fortleitung von Reizen bei Schmerzzuständen unterbrochen wird. Diese elektrischen Geräte sind weit verbreitet und klinisch etabliert, auch wenn ihre klinische Wirksamkeit häufig nicht eindeutig nachgewiesen ist, die Behandlung nur auf die Schmerzunterdrückung abzielt, und es keinen klinischen Anspruch oder Beweis dafür gibt, dass diese TENS oder TENS-ähnlichen Verfahren die Regeneration oder Heilung von krankhaft veränderten Geweben (z.B. Entzündungen oder strukturellen Defekten wie Muskel oder Sehnenrisse) verbessern.
Eine weitere Klasse von Elektrostimulationsgeräten zielt auf eine thermische oder nicht-thermische Therapie ab. Hier ist zu nennen die elektrochemische Ablation (perkutane Thermokoagulation oder Elektrolyse), um den Druck auf einen Nerv zu reduzieren (z.B. bei einem Bandscheibenvorfall), die Nozizeption zu unterbrechen oder die daraus folgende Gewebereparatur zu fördern.
Zelluläre und Transepitheliale Potentiale
Elektrophysiologische Phänomene sind jedoch nicht nur auf Aktionspotenziale beschränkt, welche durch o.g. Behandlungsformen modifiziert werden können. Neuere wissenschaftliche Erkenntnisse zeigen, dass neben Aktionspotentialen gewebespezifische zelluläre und sogenannte Transepitheliale Potentiale eine wesentliche Rolle im Heilungsprozess spielen:
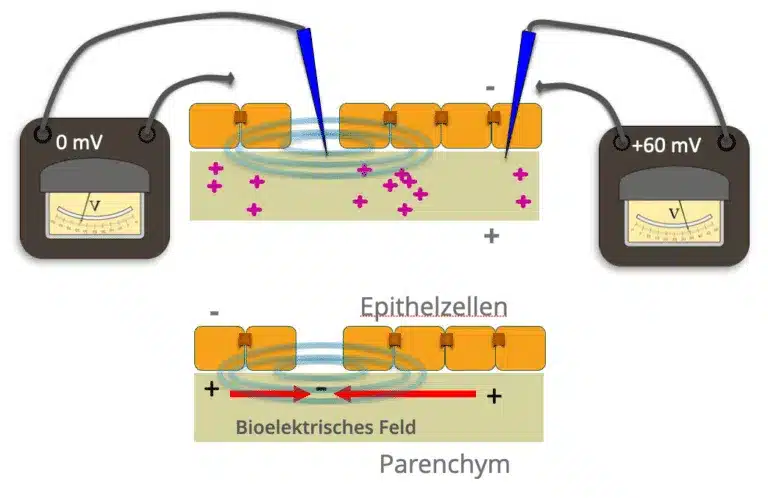
Sowohl in der extrazellulären Matrix wie auch intrazellulär finden sich geladene Ionen und Proteine / Peptide. Ionenkanäle und Ionentransporter in der Zellmembran regulieren den Fluss dieser geladenen Moleküle. Jedes Gewebe erzeugt somit elektrische Ionenströme und elektrische Felder, die eine definierte Ausrichtung und Intensität aufweisen. Diese elektrische Felder interagieren wiederum mit geladenen Ionen und Peptiden durch elektrostatische Kräfte, Elektrophorese und Elektroosmose. Zum Beispiel gehen Entzündungen des Muskelgewebes, wie sie bei schmerzhaften Triggerpunkten zu beobachten sind, mit einer lokal erhöhten Konzentration von proinflammatorischen Zytokinen, H+-Ionen, und einer daraus folgenden Azidose einher, die wiederum zu einer erhöhten elektrischen Leitfähigkeit des entzündeten Gewebes führt.
Erste neuere wissenschaftliche Erkenntnisse weisen auf die Bedeutung solcher zellulären elektrischen Felder besonders in Epithelschichten (Transepitheliale Potentiale) hin.
In Epithelgeweben generieren palisadenartig angeordneten Epithelzellen häufig einen Nettozufluss von Na+-Ionen in Richtung des Parenchyms. Epithelschichten sind hinsichtlich ihrer elektrischen Eigenschaften mit multiplen parallelgeschalteten Mikrobatterien vergleichbar. Untereinander sind Epithelzellen durch so genannte „tight junctions“, die eine elektrisch isolierende Wirkung haben, verbunden. Hierdurch wird eine Potentialdifferenz zwischen dem inneren Parenchym und den äußeren Strukturen aufrechterhalten.
Solche Transpethelialen Potentiale können in der Haut, den Faszien oder organeigenen Epithelschichten gemessen werden. Dort sind sie zum Beispiel beteiligt an der Resorptionsaktivität der Darmwand, der Filteraktivität der Niere und, das ist hier von besonderem Interesse, an der Wundheilung und Regeneration ganzer Organe.
Transepitheliale Potentiale und Wundheilung
So kommt es, wenn Epithelwunden die „tight junctions“ zerstören und zusätzlich noch ein lokales Ödem (Wassereinlagerung) erzeugen, im Bereich einer Wunde zu einem lokalen Zusammenbruch des elektrischen Widerstandes und damit zu einem Kurzschluss des Transpithelialen Potentials. Abhängig von der Größe und der Lokalisation der Wunde sowie auch der Species und der Art des verletzten Gewebes, werden hierdurch elektrische Felder erzeugt, die in der Größenordnung von 140 mV/ mm liegen. Eine Vielzahl neuer grundlagenwissenschaftlicher Arbeiten haben die Bedeutung dieser elektrischen Felder für die Steuerung von Zellen untersucht. So stimulieren diese biologischen elektrischen Felder die Migration von Entzündungszellen, Epithelzellen und Fibroblasten. Abhängig von der Ausrichtung und Intensität der elektrischen Felder wandern Fibroblasten in Richtung der Wunde oder von ihr weg. Dies führt zu einem Öffnen oder Schließen der Wunde. Neue klinische Anwendungen im Bereich des in vitro Tissue Engineering und zur Förderung der Wundheilung wurden durch dieses erst kürzlich erworbene elektrophysiologische Wissen inspiriert.
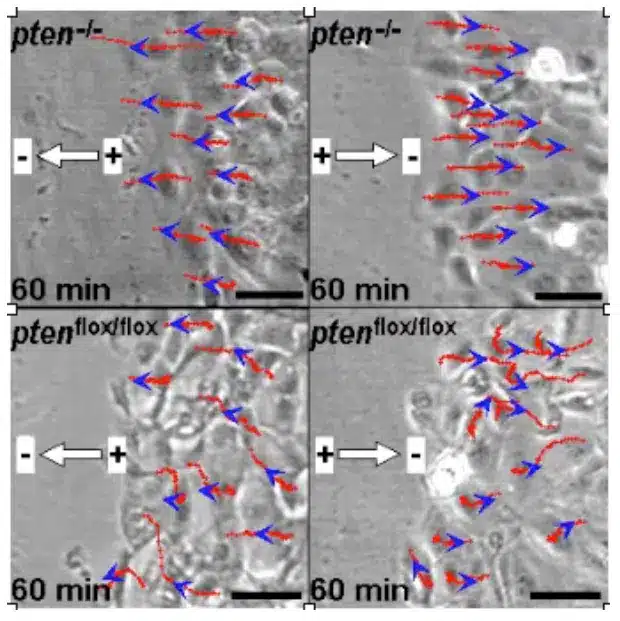
Weiterhin stimulieren und steuern diese elektrischen Felder auch das Wachstum von Spinalneuronen, Astrozyten, mesenchymalen Stammzellen, Monozyten und Makrophagen.
Tatsächlich werden heute von einigen Autoren diese biologischen elektrischen Felder als fundamentale elektrische Signalgeber für die Wundheilung und Geweberegeneration bei Säugetieren angesehen.

So ist der Axolotl (Ambystoma mexicanum) bekanntlich in der Lage, verletzte Gliedmaßen und Organe, selbst Teile des Herzens und Gehirns, vollständig wiederherzustellen, und er erzeugt während der Regenerationshase genau solche oben beschriebenen elektrische Felder mit einer definierten Ausrichtung und Intensität.
Elektrische Potentiale und Entzündung
Eine Entzündung wird auf Zellebene durch entzündungsfördernde Zellhormone, sogenannte proinflammatorische Zytokine vermittelt (u.a. Substance P, Bradykinin, TNF-Alpha, Interleukine). Daneben bilden sich durch den Abbau von Zelleiweißen saure Substanzen. Im Bereich der Entzündung entsteht ein saures Milieu, der pH-Wert sinkt. Letztlich werden durch diese Prozesse Gewebe abgebaut und die Schmerzrezeptoren sensibilisiert. Aufweichung, Rötung, Schwellung und der typische Entzündungsschmerz ist die Folge.
Neben der Wundheilung erfolgt auch die Steuerung dieser Entzündungsprozesse durch zelluläre- und Transepitheliale Potentiale. Diese Potentiale sind nach heutiger Erkenntnis somit fundamentale Signalgeber, die den physiologischen, zeitlich genau koordinierten Prozess von Entzündung und Heilung orchestrieren.
Axomera Therapie
Haupteinsatzgebiet der Axomera Therapie (Wissenschaftlicher Name: Percutaneous Bioelectric Current Stimulation – PBCS) sind Erkrankungen des Bewegungsapparates, der Sportmedizin, einzelne, auch schwerste neurologische Schmerzerkrankungen, sowie die saisonale Allergie.
Bei der Axomera Therapie wird durch einen Mikroprozessor ein undulierender, unipolarer, Strom im Mikroamperebereich erzeugt und patientenindividuell geregelt, der mit Hilfe von feinen elektrischen Sonden punktgenau an das erkrankte Gewebe platziert wird. Hierbei werden für den Menschen adaptierte elektrische Felder in der Dimension zellulärer und Transepithelialer Potentiale generiert, die ähnlich auch während der Regenerationsphase des Axolotls gemessen werden können.
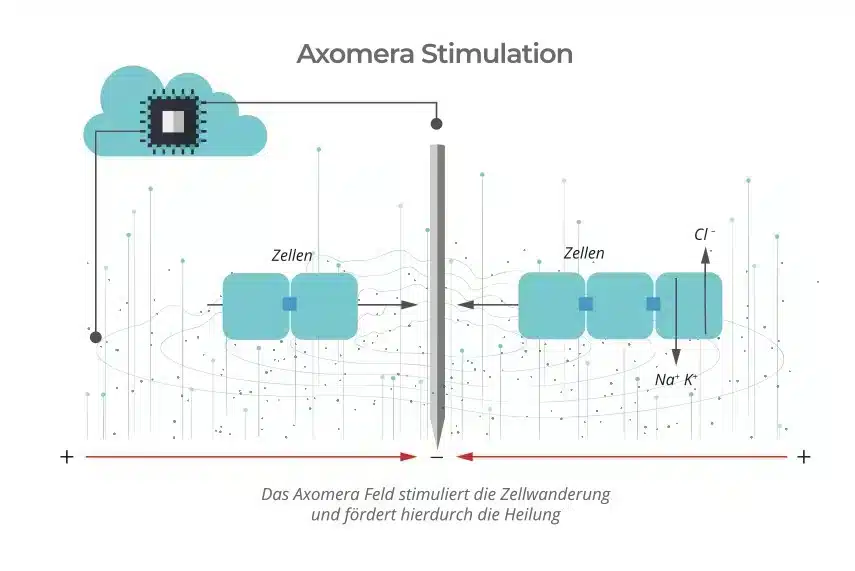
Mit diesen elektrischen Parametern unterscheidet sich die Axomera-Therapie von allen oben beschriebenen TENS und TENS ähnlichen, medizinischen Stimulationsverfahren.
Klinisch werden zwei verschiedene Effekte der Axomera Therapie beobachtet, ein „sofortanalgetischer“ entzündungshemmender Effekt und ein regenerativer Langzeiteffekt.
Phase 1
Entzündungshemmung und Schmerzreduktion
Erkrankungen des Bewegungsapparates und neurologischen Schmerzerkrankungen liegen häufig lokale nicht bakterielle Entzündungen (aseptisch) von Sehnen, Bändern, Muskeln, Gelenkkapseln und Nerven zu Grunde. Mit Axomera werden lokal in diesem pathologischen Gewebe die zellulären und Transepithelialen Potentiale so moduliert, dass eine entzündungsbedingte saure pH Verschiebung gepuffert wird. Zudem kommt es vermutlich zu einer Neutralisation proinflammatorische Zytokine und damit zu einer Desensibilisierung der den Schmerz vermittelnden Nozizeptoren. Dies entspricht der klinischen Beobachtung, dass nach einer Axomera-Therapie bereits in einem Zeitraum von 60 – 90 Minuten eine Abnahme der typischen Entzündungsparameter – Schwellung, Rötung und Schmerz – beobachtet werden kann. Zudem liegt in der antientzündlichen Komponente auch ein möglicher Erklärungsansatz für den klinisch beobachteten Effekt bei saisonaler Allergie (Augen – und Nasensymptome bei Heuschnupfen).
Phase 2
Langzeiteffekt und Regeneration
Wie oben ausgeführt steuern zelluläre elektrische Felder und Transepitheliale Potentiale die Wundheilung. Hierbei kommt es zur gerichteten Migration elektrosensitiver Zellen. Entsprechend der aktuellen Literatur kann die Modulation dieser Potentiale die Zellmigration von o.g. Zellen (Fibroblasten, Epithelzellen, Neurozyten, Stammzellen) beeinflussen. Ziel ist es durch die Axomerastimulation die Zellmigration und damit die Regeneration des pathologischen Gewebes zu beschleunigen oder bei chronischen Erkrankungen überhaupt erst in Gang zu setzen. Dies ist nach aktueller Wissenslage die naheliegende Erklärung der klinisch zu beobachtende Langzeiteffekt der Axomera-Therapie.
Die (I) Pufferung des sauren Zell Milieus mit Neutralisation proinflammatorischer Zytokine, und die (II) Modifikation der Migration elektrosensitiver Zellen –unterscheidet die Axomera-Therapie auch klinisch grundlegend von allen uns bisher bekannten elektrischen Stimulationsverfahren der Medizin.
Auf Grund des nach unserer Kenntnis völlig neuen Therapieansatz erschließt die mehrfach patentierte Axomera Therapie somit eine neue Therapieklasse in der konservativen Medizin und wird als transformatorisches Therapieverfahren gewertet.
Fallbeispiel zur Regeneration von Muskel
Ein 19jähriger professioneller Fußballer erlitt in der zweiten Hälfte des Spiels einen stechenden Schmerz im rechten Oberschenkel. Der Arzt am Spielfeldrand diagnostizierte einen Muskelfaserriss, der sich im Kernspin bestätigte, und er prognostizierte auf Grund der Größe der Verletzung eine Spielausfallzeit von mindestens drei Monaten.
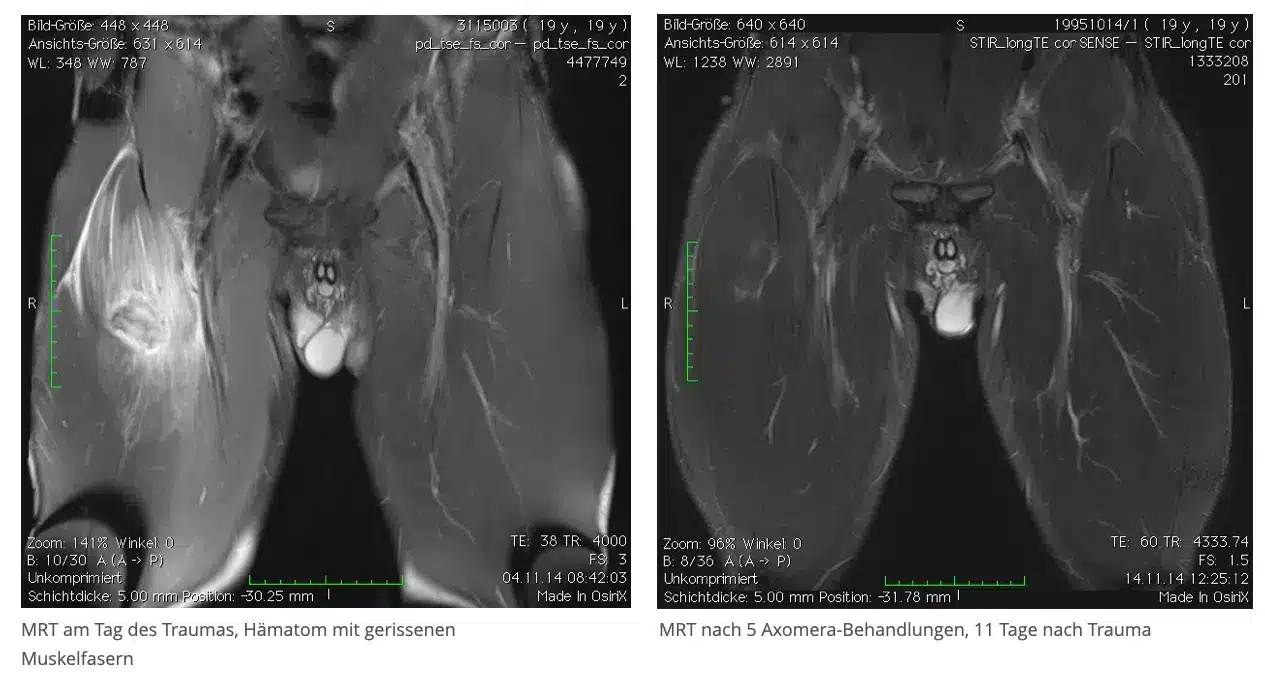
Der Spieler erhielt in den folgenden 10 Tagen fünf Axomera Therapien. Nach der zweiten Behandlung ließen die Beschwerden nach, nach der 4. Behandlung konnte er schmerzfrei belasten.
Literatur
- Nnoaham KE, Kumbang J. Transcutaneous electrical nerve stimulation (TENS) for chronic pain. Cochrane Database Syst Rev. 2008;(3):CD003222. http://eutils.ncbi.nlm.nih.gov/entrez/eutils/elink.fcgi?dbfrom=pubmed&id=18646088&retmode=ref&cmd=prlinks.
- Shamji MF, De Vos C, Sharan A. The Advancing Role of Neuromodulation for the Management of Chronic Treatment-Refractory Pain. Neurosurgery. 2017;80(3):S108-S113. doi:10.1093/neuros/nyw047.
- Petersen EA, Slavin K V. Peripheral nerve/field stimulation for chronic pain. Neurosurg Clin N Am. 2014;25(4):789-797. doi:10.1016/j.nec.2014.07.00
- García Naranjo J, Barroso Rosa S, Loro Ferrer JF, Limiñana Cañal JM, Suarez Hernández E. A novel approach in the treatment of acute whiplash syndrome: Ultrasound-guided needle percutaneous electrolysis. A randomized controlled trial. Orthop Traumatol Surg Res. 2017;103(8):1229-1234. doi:10.1016/j.otsr.2017.09.012.
- McCaig CD, Song B, Rajnicek AM. Electrical dimensions in cell science. J Cell Sci. 2009;122(23):4267-4276. doi:10.1242/jcs.023564.
- Shah JP, Danoff J V, Desai MJ, et al. Biochemicals associated with pain and inflammation are elevated in sites near to and remote from active myofascial trigger points.Arch Phys Med Rehabil. 2008;89(1):16-23. papers2://publication/doi/10.1016/j.apmr.2007.10.018.
- Mccaig CD, Rajnicek AM, Song B, Zhao M. Controlling cell behavior electrically: current views and future potential. Physiol Rev. 2005;85(3):943-978. papers2://publication/doi/10.1152/physrev.00020.2004.
- Electrical Stimulation Promotes Wound Healing by Enhancing Dermal Fibroblast Activity and Promoting Myofibroblast Transdifferentiation. papers2://publication/uuid/BDA69EA5-A0A4-463F-8C45-9D6AB9822CB4.
- Borgens RB, Vanable JW, Jaffe LF. Bioelectricity and regeneration. I. Initiation of frog limb regeneration by minute currents. J Exp Zool. 1977;200(3):403-416. doi:10.1002/jez.1402000310.
- Leppik LP, Froemel D, Slavici A, et al. Effects of electrical stimulation on rat limb regeneration, a new look at an old model. Sci Rep. 2015;5:18353. doi:10.1038/srep18353.
- Baer ML, Colello RJ. Endogenous bioelectric fields: A putative regulator of wound repair and regeneration in the central nervous system. Neural Regen Res. 2016;11(6):861-864. doi:10.4103/1673-5374.184446.
- Zhao M, Song B, Pu J, et al. Electrical signals control wound healing through phosphatidylinositol-3-OH kinase-gamma and PTEN. Nature. 2006;442(7101):457-460. http://www.nature.com/nature/journal/v442/n7101/full/nature04925.html.
- Borgens RB, Jaffe LF, Cohen MJ. Large and persistent electrical currents enter the transected lamprey spinal cord. Proc Natl Acad Sci U S A. 1980;77(2):1209-1213. doi:10.1073/pnas.77.2.1209.
- Baer ML, Henderson SC, Colello RJ. Elucidating the Role of Injury-Induced Electric Fields (EFs) in Regulating the Astrocytic Response to Injury in the Mammalian Central Nervous System. Hu W, ed. PLoS One. 2015;10(11):e0142740. doi:10.1371/journal.pone.0142740.
- Zhao Z, Watt C, Karystinou A, et al. Directed migration of human bone marrow mesenchymal stem cells in a physiological direct current electric field. Eur Cell Mater. 2011;22:344-358. http://eutils.ncbi.nlm.nih.gov/entrez/eutils/elink.fcgi?dbfrom=pubmed&id=22125259&retmode=ref&cmd=prlinks.
- Hoare JI, Rajnicek AM, Mccaig CD, Barker RN, Wilson HM. Electric fields are novel determinants of human macrophage functions. 2016;99(June):1-11. doi:10.1189/jlb.3A0815-390R.
- Balint R, Cassidy NJ, Cartmell SH. Electrical Stimulation: A Novel Tool for Tissue Engineering. Tissue Eng Part B Rev. 2013;19(1):48-57. http://online.liebertpub.com/doi/abs/10.1089/ten.teb.2012.0183.

