Campos eléctricos en la naturaleza y en el organismo humano
Los potenciales eléctricos se encuentran por doquier en la naturaleza y, como fuerza física, influyen en diversos fenómenos naturales: desde la descarga de la atmósfera hasta las auroras, la formación de nubes, las cascadas y la forma de los copos de nieve. Los organismos biológicos pueden generar potenciales eléctricos, como la anguila eléctrica (Electrophorus electricus), o utilizarlos como campos electromagnéticos para orientarse, como en las aves migratorias y los murciélagos.
En electrofisiología humana se sabe desde hace tiempo que las corrientes eléctricas controlan, por ejemplo, la actividad cardíaca, permiten además el procesamiento de señales de los órganos sensoriales, como en las células ciliadas del oído o las fotosensibles del ojo, y son fundamentales para la función cerebral y los potenciales de acción nerviosos. Esta electrofisiología conocida desde hace tiempo es la base de todos los procedimientos de estimulación electromédica conocidos, desde la estimulación nerviosa eléctrica transcutánea (TENS) hasta los marcapasos cardíacos, los desfibriladores o incluso los procedimientos más recientes para la terapia de la enfermedad de Parkinson o la depresión (estimulación cerebral profunda – ECP).
Métodos de estimulación médica conocidos hasta ahora en la terapia del dolor
Casi todos los métodos anteriores de estimulación electromédica para la terapia del dolor se dirigen a la actividad de los potenciales de acción de los nociceptores periféricos (receptores del dolor). La percepción del dolor debe modificarse con las corrientes y/o frecuencias más altas posibles.
Estos procedimientos incluyen la estimulación nerviosa eléctrica transcutánea (TENS), la estimulación percutánea (por ejemplo, electroacupuntura) o la implantación quirúrgica de dispositivos como estimuladores nerviosos periféricos (PNS), estimuladores de la médula espinal (SCS) o estimuladores del ganglio de la raíz dorsal (DRG). Todos estos dispositivos de estimulación eléctrica funcionan de forma similar y utilizan el mismo principio electrofisiológico. Los estímulos eléctricos bipolares dinámicos pulsados (1-70 V, 1-90 mA, 1-1200 Hz, anchura de pulso de 0,2-250 ms) se utilizan para “sobrecargar” las células nerviosas de modo que dejen de generar potenciales de acción, interrumpiendo así la conducción de estímulos en estados de dolor. Estos dispositivos eléctricos son ampliamente utilizados y están clínicamente establecidos, a pesar de que su eficacia clínica no suele estar claramente demostrada, de que el tratamiento está dirigido únicamente a la supresión del dolor y de que no existe ninguna afirmación o prueba clínica de que estos procedimientos TENS o similares mejoren la regeneración o curación de tejidos patológicamente alterados (por ejemplo, inflamación o defectos estructurales como desgarros musculares o tendinosos).
Otra clase de dispositivos de electroestimulación se dirige a la terapia térmica o no térmica. Entre ellas se incluye la ablación electroquímica (termocoagulación percutánea o electrólisis) para reducir la presión sobre un nervio (por ejemplo, en el caso de una hernia discal), interrumpir la nocicepción o favorecer la reparación tisular resultante.
Potenciales celulares y transepiteliales
Los fenómenos electrofisiológicos no se limitan a los potenciales de acción, que pueden modificarse mediante las formas de tratamiento mencionadas. Recientes descubrimientos científicos demuestran que, además de los potenciales de acción, los potenciales celulares específicos del tejido y los denominados potenciales transepiteliales desempeñan un papel esencial en el proceso de cicatrización:
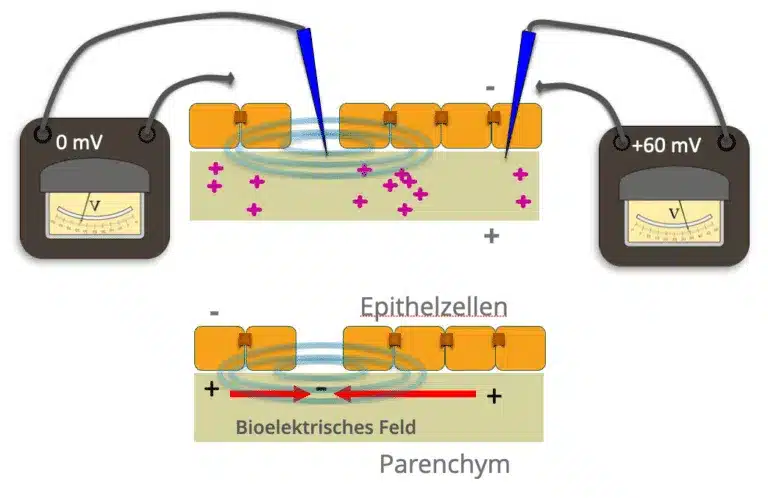
Los iones cargados y las proteínas / péptidos se encuentran tanto en la matriz extracelular como intracelularmente. Los canales iónicos y los transportadores de iones de la membrana celular regulan el flujo de estas moléculas cargadas. Cada tejido genera así corrientes eléctricas de iones y campos eléctricos que tienen una orientación y una intensidad definidas. A su vez, estos campos eléctricos interactúan con los iones cargados y los péptidos mediante fuerzas electrostáticas, electroforesis y electroósmosis. Por ejemplo, la inflamación del tejido muscular, como se observa en los puntos gatillo dolorosos, se asocia a un aumento local de la concentración de citoquinas proinflamatorias, iones H+ y la consiguiente acidosis, que a su vez provoca un aumento de la conductividad eléctrica del tejido inflamado.
Los primeros descubrimientos científicos recientes apuntan a la importancia de estos campos eléctricos celulares, especialmente en las capas epiteliales (potenciales transepiteliales).
En los tejidos epiteliales, las células epiteliales en empalizada suelen generar una afluencia neta de iones Na+ hacia el parénquima. En cuanto a sus propiedades eléctricas, las capas epiteliales son comparables a múltiples microbaterías conectadas en paralelo. Las células epiteliales están unidas entre sí por las llamadas “uniones estrechas”, que tienen un efecto aislante de la electricidad. Esto mantiene una diferencia de potencial entre el parénquima interno y las estructuras externas.
Estos potenciales transteliales pueden medirse en la piel, la fascia o las capas epiteliales de los órganos. Allí intervienen, por ejemplo, en la actividad de absorción de la pared intestinal, la actividad de filtración del riñón y, esto es de especial interés aquí, en la cicatrización de heridas y la regeneración de órganos enteros.
Potenciales transepiteliales y cicatrización de heridas
Así, cuando las heridas epiteliales destruyen las “uniones estrechas” y producen además un edema local (retención de agua), se produce una ruptura local de la resistencia eléctrica en la zona de la herida y, por tanto, un cortocircuito del potencial transpitelial. Dependiendo del tamaño y la localización de la herida, así como de la especie y el tipo de tejido lesionado, se generan campos eléctricos del orden de 140 mV/ mm. Una gran cantidad de nuevos trabajos de ciencia básica han investigado la importancia de estos campos eléctricos para el control de las células. Así, estos campos eléctricos biológicos estimulan la migración de células inflamatorias, células epiteliales y fibroblastos. En función de la orientación y la intensidad de los campos eléctricos, los fibroblastos migran hacia la herida o se alejan de ella. Esto hace que la herida se abra o se cierre. Las nuevas aplicaciones clínicas en el campo de la ingeniería de tejidos in vitro y para promover la cicatrización de heridas se han inspirado en estos conocimientos electrofisiológicos recientemente adquiridos.
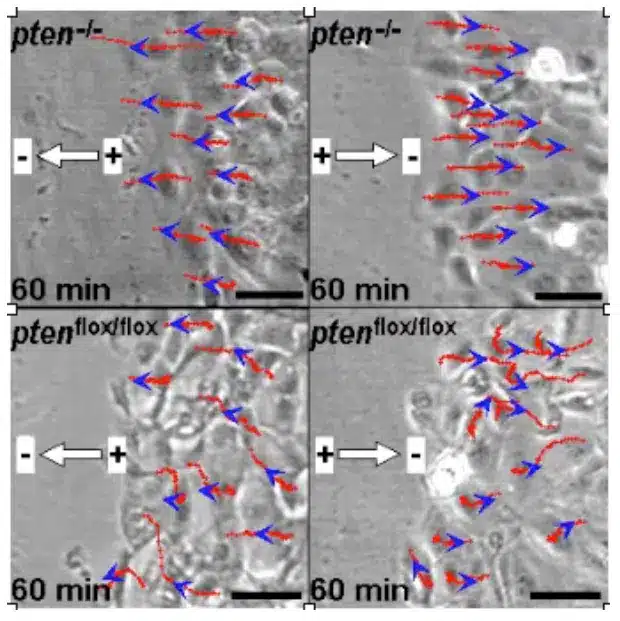
Además, estos campos eléctricos también estimulan y controlan el crecimiento de neuronas espinales, astrocitos, células madre mesenquimales, monocitos y macrófagos.
De hecho, algunos autores consideran actualmente que estos campos eléctricos biológicos son señalizadores eléctricos fundamentales para la cicatrización de heridas y la regeneración de tejidos en mamíferos.

Por ejemplo, se sabe que el ajolote (Ambystoma mexicanum) es capaz de restaurar completamente miembros y órganos lesionados, incluso partes del corazón y el cerebro, y genera exactamente los campos eléctricos descritos anteriormente con una orientación e intensidad definidas durante la fase de regeneración.
Potenciales eléctricos e inflamación
La inflamación está mediada a nivel celular por hormonas celulares proinflamatorias, las llamadas citoquinas proinflamatorias (entre ellas, la sustancia P, la bradicinina, el TNF-alfa y las interleucinas). Además, se forman sustancias ácidas a través de la degradación de las proteínas celulares. Se desarrolla un entorno ácido en la zona de la inflamación, el valor del pH disminuye. En última instancia, estos procesos descomponen el tejido y sensibilizan los receptores del dolor. El resultado es reblandecimiento, enrojecimiento, hinchazón y el típico dolor inflamatorio.
Además de la cicatrización de heridas, estos procesos inflamatorios también están controlados por potenciales celulares y transepiteliales. Según los conocimientos actuales, estos potenciales son, por tanto, señalizadores fundamentales que orquestan el proceso fisiológico, cronometrado con precisión, de la inflamación y la cicatrización.
Axoterapia
El principal campo de aplicación de la terapia Axomera (nombre científico: Estimulación Bioeléctrica Percutánea por Corriente – PBCS) son las enfermedades del sistema musculoesquelético, la medicina deportiva, individual, incluso las enfermedades neurológicas más graves de dolor, así como las alergias estacionales.
En la terapia Axomera, un microprocesador genera y regula individualmente para cada paciente una corriente ondulante unipolar en el rango de los microamperios, que se coloca con precisión sobre el tejido enfermo con ayuda de finas sondas eléctricas. Aquí se generan campos eléctricos adaptados a los humanos en la dimensión de potenciales celulares y transepiteliales, que pueden medirse de forma similar durante la fase de regeneración del ajolote.
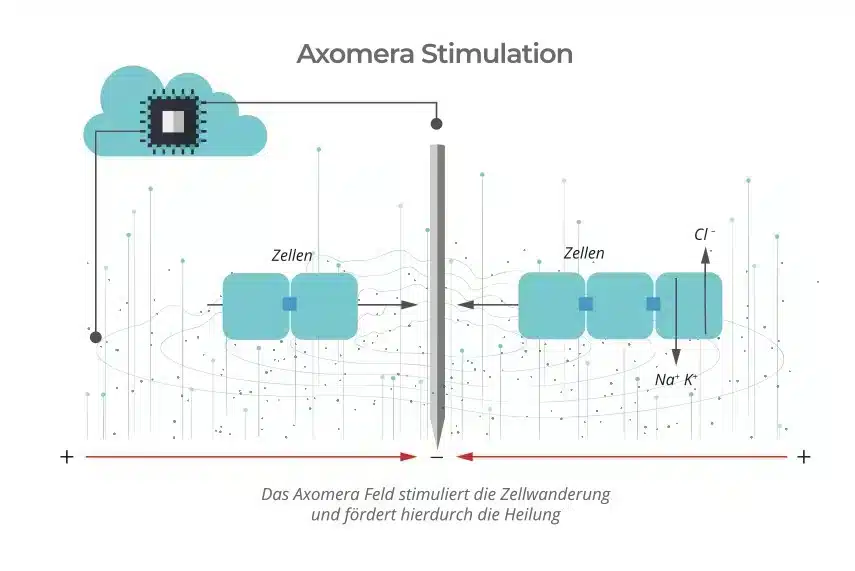
Con estos parámetros eléctricos, la terapia Axomera se diferencia de todos los métodos de estimulación médica TENS y similares a TENS descritos anteriormente.
Clínicamente, se observan dos efectos diferentes de la terapia Axomera, un efecto antiinflamatorio “analgésico inmediato” y un efecto regenerativo a largo plazo.
Fase 1
Antiinflamatorio y reductor del dolor
Las enfermedades del sistema musculoesquelético y los trastornos neurológicos del dolor suelen basarse en inflamaciones locales no bacterianas (asépticas) de tendones, ligamentos, músculos, cápsulas articulares y nervios. Axomera se utiliza para modular localmente los potenciales celulares y transepiteliales en este tejido patológico, de forma que se amortigüe el cambio de pH ácido relacionado con la inflamación. Además, presumiblemente se produce una neutralización de las citocinas proinflamatorias y, por tanto, una desensibilización de los nociceptores que median el dolor. Esto se corresponde con la observación clínica de que, tras la terapia con Axomera, ya se puede observar una disminución de los parámetros típicos de la inflamación – hinchazón, enrojecimiento y dolor – en un periodo de 60 a 90 minutos. Además, el componente antiinflamatorio es también una posible explicación del efecto clínicamente observado en la alergia estacional (síntomas oculares y nasales en la fiebre del heno).
Fase 2
Efecto a largo plazo y regeneración
Como ya se ha explicado, los campos eléctricos celulares y los potenciales transepiteliales controlan la cicatrización de las heridas. El resultado es la migración dirigida de las células electrosensibles. Según la bibliografía actual, la modulación de estos potenciales puede influir en la migración celular de las células mencionadas (fibroblastos, células epiteliales, neurocitos, células madre). El objetivo de la estimulación de los axómeros es acelerar la migración celular y, por tanto, la regeneración del tejido patológico o, en el caso de las enfermedades crónicas, ponerlo en marcha en primer lugar. Según los conocimientos actuales, ésta es la explicación obvia del efecto a largo plazo clínicamente observado del tratamiento con Axomera.
En (I) Amortiguación del entorno celular ácido con neutralización de las citoquinas proinflamatorias, y la (II) Modificación de la migración de las células electrosensibles – también distingue clínicamente de forma fundamental la terapia Axomera de todos los métodos de estimulación eléctrica en medicina conocidos hasta ahora.
Debido al enfoque terapéutico completamente nuevo según nuestros conocimientos, la terapia multipatentada Axomera abre así una nueva clase de terapia en la medicina conservadora y se considera un método terapéutico transformador.
Caso práctico de regeneración muscular
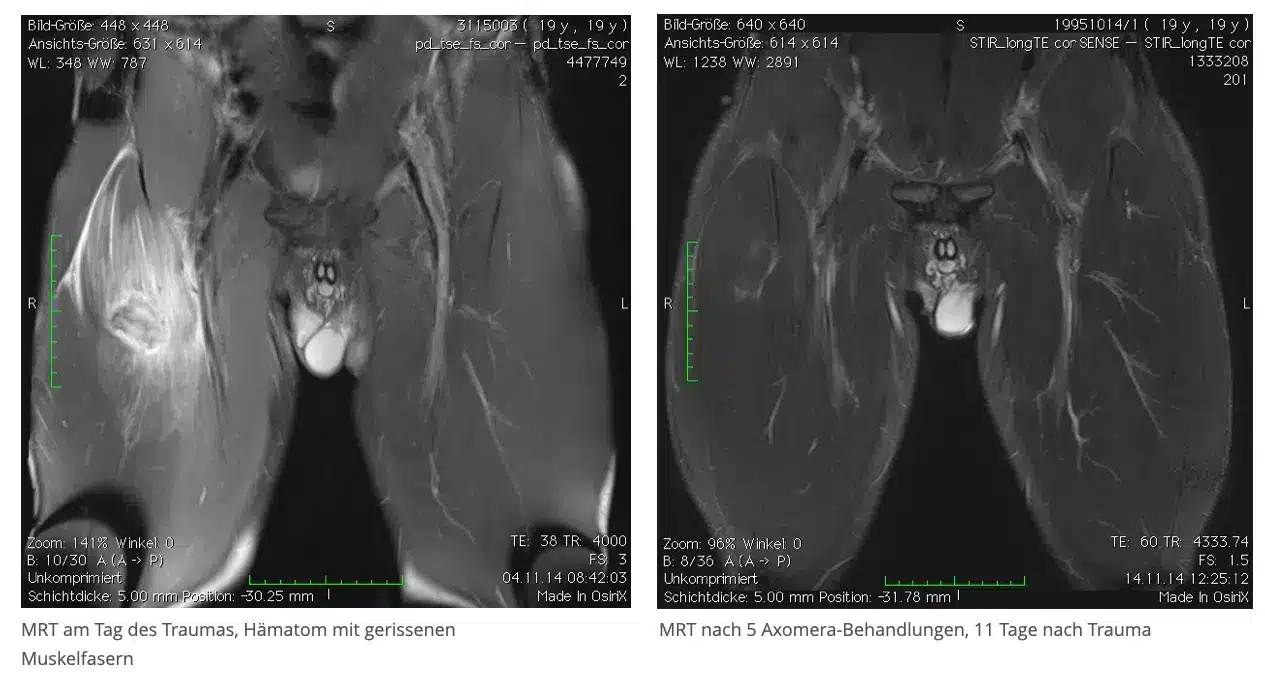
Un futbolista profesional de 19 años sufrió un dolor punzante en el muslo derecho durante la segunda parte del partido. El médico de la banda le diagnosticó un desgarro de fibras musculares, confirmado en la resonancia magnética, y le pronosticó al menos tres meses de baja debido a la envergadura de la lesión.
El jugador recibió cinco terapias Axomera durante los 10 días siguientes. Tras el segundo tratamiento, las molestias remitieron y, tras el cuarto, pudo soportar peso sin dolor.
Literatura
- Nnoaham KE, Kumbang J. Transcutaneous electrical nerve stimulation (TENS) for chronic pain (Estimulación nerviosa eléctrica transcutánea para el dolor crónico). Base de datos Cochrane Syst Rev. 2008;(3):CD003222. http://eutils.ncbi.nlm.nih.gov/entrez/eutils/elink.fcgi?dbfrom=pubmed&id=18646088&retmode=ref&cmd=prlinks.
- Shamji MF, De Vos C, Sharan A. The Advancing Role of Neuromodulation for the Management of Chronic Treatment-Refractory Pain. Neurocirugía. 2017;80(3):S108-S113. doi:10.1093/neuros/nyw047.
- Petersen EA, Slavin K V. Peripheral nerve/field stimulation for chronic pain. Neurosurg Clin N Am. 2014;25(4):789-797. doi:10.1016/j.nec.2014.07.00
- García Naranjo J, Barroso Rosa S, Loro Ferrer JF, Limiñana Cañal JM, Suarez Hernández E. Un enfoque novedoso en el tratamiento del síndrome del latigazo cervical agudo: electrólisis percutánea con aguja guiada por ecografía. Ensayo controlado aleatorizado. Orthop Traumatol Surg Res. 2017;103(8):1229-1234. doi:10.1016/j.otsr.2017.09.012.
- McCaig CD, Song B, Rajnicek AM. Dimensiones eléctricas en la ciencia celular. J Cell Sci. 2009;122(23):4267-4276. doi:10.1242/jcs.023564.
- Shah JP, Danoff J V, Desai MJ, et al. Las sustancias bioquímicas asociadas con el dolor y la inflamación aumentan en las zonas cercanas y alejadas de los puntos gatillo miofasciales activos.Arch Phys Med Rehabil. 2008;89(1):16-23. papers2://publication/doi/10.1016/j.apmr.2007.10.018.
- Mccaig CD, Rajnicek AM, Song B, Zhao M. Control del comportamiento celular eléctricamente: puntos de vista actuales y potencial futuro. Physiol Rev. 2005;85(3):943-978. papers2://publication/doi/10.1152/physrev.00020.2004.
- La estimulación eléctrica favorece la cicatrización de heridas al aumentar la actividad de los fibroblastos dérmicos y promover la transdiferenciación de los miofibroblastos. papers2://publication/uuid/BDA69EA5-A0A4-463F-8C45-9D6AB9822CB4.
- Borgens RB, Vanable JW, Jaffe LF. Bioelectricidad y regeneración. I. Iniciación de la regeneración de las extremidades de la rana por corrientes diminutas. J Exp Zool. 1977;200(3):403-416. doi:10.1002/jez.1402000310.
- Leppik LP, Froemel D, Slavici A, et al. Efectos de la estimulación eléctrica en la regeneración de las extremidades de la rata, una nueva mirada a un viejo modelo. Sci Rep. 2015;5:18353. doi:10.1038/srep18353.
- Baer ML, Colello RJ. Campos bioeléctricos endógenos: un regulador putativo de la reparación y regeneración de heridas en el sistema nervioso central. Neural Rain Res. 2016;11(6):861-864. doi:10.4103/1673-5374.184446.
- Zhao M, Song B, Pu J, et al. Las señales eléctricas controlan la cicatrización de heridas a través de la fosfatidilinositol-3-OH quinasa-gamma y PTEN. Naturaleza. 2006;442(7101):457-460. http://www.nature.com/nature/journal/v442/n7101/full/nature04925.html.
- Borgens RB, Jaffe LF, Cohen MJ. Grandes y persistentes corrientes eléctricas entran en la médula espinal de la lamprea transectada. Proc Natl Acad Sci U S A. 1980;77(2):1209-1213. doi:10.1073/pnas.77.2.1209.
- Baer ML, Henderson SC, Colello RJ. Elucidando el Papel de los Campos Eléctricos Inducidos por Lesiones (EFs) en la Regulación de la Respuesta Astrocítica a la Lesión en el Sistema Nervioso Central de Mamíferos. Hu W, ed. PLoS One. 2015;10(11):e0142740. doi:10.1371/journal.pone.0142740.
- Zhao Z, Watt C, Karystinou A, et al. Migración dirigida de células madre mesenquimales de médula ósea humana en un campo eléctrico fisiológico de corriente continua. Eur Cell Mater. 2011;22:344-358. http://eutils.ncbi.nlm.nih.gov/entrez/eutils/elink.fcgi?dbfrom=pubmed&id=22125259&retmode=ref&cmd=prlinks.
- Hoare JI, Rajnicek AM, Mccaig CD, Barker RN, Wilson HM. Los campos eléctricos son nuevos determinantes de las funciones de los macrófagos humanos. 2016;99(June):1-11. doi:10.1189/jlb.3A0815-390R.
- Balint R, Cassidy NJ, Cartmell SH. Estimulación eléctrica: una herramienta novedosa para la ingeniería tisular. Tissue Eng Part B Rev. 2013;19(1):48-57. http://online.liebertpub.com/doi/abs/10.1089/ten.teb.2012.0183.

